脑科学研究是生物医学领域的重要研究方向,直接的脑显微成像是研究大脑结构及功能的有效手段。多光子显微成像信噪比高、成像深度大、光漂白与光毒性小,近年来发展迅速,被广泛应用于脑成像研究中。

南京理工大学电子工程与光电技术学的薛璐团队发表文章,描述了多光子显微成像技术的原理及系统组成,结了近年来脑成像应用中,多光子显微成像在成像速度、成像深度及系统小型化三个方面的进展,并展望了其未来发展前景。
研究背景
脑科学作为极具发展前景的领域,开展基础脑功能及脑部疾病的研究对人工智能、教育及医疗等诸多领域的发展具有深远意义。大脑是人体*为复杂和神秘的器官,深入理解其结构与功能的运作机制,是解锁众多科学与技术难题的关键。
目前,计算机断层扫描(CT)、磁共振成像(MRI)、正电子发射计算机断层扫描(PET)、功能性磁共振成像(FMRI)等技术在基础研究及临床医疗中广泛应用于大脑结构及功能成像。然而,这些方法的空间分辨率处于厘米量级,仅能确定较为粗糙的结构及功能改变,难以满足对大脑微观世界深入探索的需求。
与之相比,光学显微方法中的多光子成像技术(Multiphoton Microscopy,MPM)脱颖而出。它具备亚细胞分辨率以及三维和深度成像能力,并且光漂白和光毒性小。多光子显微镜能够对完整大脑中的神经胶质细胞、血管结构、神经元回路、树突棘以及亚细胞成分等进行高空间分辨率成像,为研究大脑生理过程以及阿尔茨海默病、脑卒中、脑肿瘤等典型脑部疾病提供了强有力的工具。
随着脑科学研究的不断深入,对脑成像技术提出了更高的要求。在成像深度方面,需要能够对皮层下方如海马体、丘脑、下丘脑等更深处的脑区进行成像;成像速度上,要足够快以记录神经元的快速活动;装置灵活性方面,期望有更小的成像装置以便对运动的样本进行灵活成像。这些需求促使研究人员对多光子显微镜不断进行创新与改进,以提升其性能。
多光子成像技术简介
一、原理
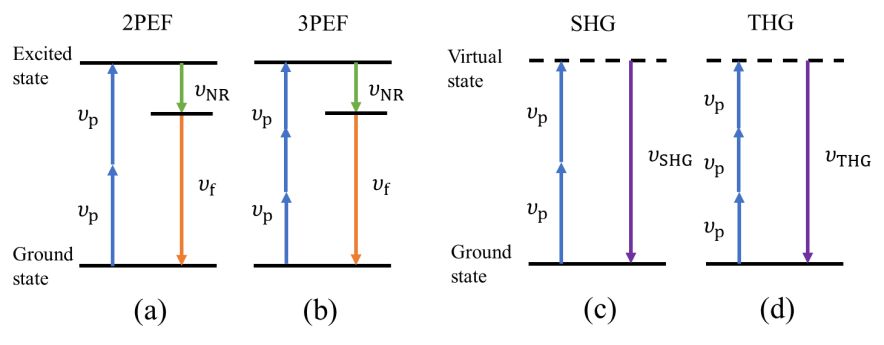
多光子显微镜的成像原理基于短脉冲激光与样品相互作用时产生的非线性光学效应,主要包括激发荧光和谐波产生。
1、多光子激发荧光成像(2PEF和3PEF)
双光子荧光显微术(two-photon excited fluorescence microscopy,2PEF)和三光子荧光显微术(three-photon excited fluorescence microscopy,3PEF)利用多光子同时被荧光物质吸收,使其跃迁到高能级,经过振动态的无辐射跃迁后辐射出荧光光子。其中,2PEF辐射出的荧光光子频率略小于激发光频率的2倍,3PEF辐射出的荧光光子频率略小于激发光频率的3倍。这种成像方式通过收集辐射光子信号来构建图像。
非线性光学跃迁过程能级图
多光子激发荧光的信号来源广泛,可来自外源探针、荧光蛋白或内源性组织分子。内源性组织分子产生的多光子自荧光已被用于识别和定量烟酰胺腺嘌呤二核苷酸、黄素腺嘌呤二核苷酸、色氨酸等代谢分子,但存在可监测分子种类有限和内源信号强度弱的局限性。为增强信号,大量抗体和荧光标记物被开发用于标记感兴趣的组织成分,如Ca²⁺指示剂、遗传编码的电压指示剂等。
2、谐波成像(SHG和THG)
二次谐波(second harmonic generation,SHG)和三次谐波(third harmonic generation,THG)成像利用处于基态的分子在吸收多个光子后到达虚拟能级,然后直接辐射出高频光子的原理。SHG辐射出的光子频率是入射光子频率的2倍,THG辐射出的光子频率是入射光子频率的3倍。谐波信号的产生与样本材料的非线性极化率相关,反映了样本材料的微观特性,如电子态、分子的对称性、旋向及排列等。
SHG通常发生在具有非中心对称性的化学结构中,如胶原蛋白、肌球蛋白、微管、丝、淀粉和纤维素等;THG则常用于高折射率物质或两种折射率均匀材料的界面成像,如细胞膜、脂滴、弹性蛋白纤维、钙化骨和胶原束或肌肉纤维等。
3、多光子成像技术的特点
多光子成像技术在对同一种荧光物质成像时,使用的激发波长比单光子长,波长越长的激发光在生物组织中穿透能力越强,有效解决了生物组织中深层物质的成像问题。
多光子激发是一个非线性过程,只有在激发光焦点附近的有限区域才能达到产生荧光所需的激光照射功率密度,非焦点区域不会产生荧光,减少了焦点外的光漂白和光毒性,适合活体的长时间成像。
多光子成像通过对焦点的三维移动即可获得样品的三维显微图像,具有天然的光学层析和三维成像能力,在脑成像领域展现出巨大的应用潜力。
二、典型光路
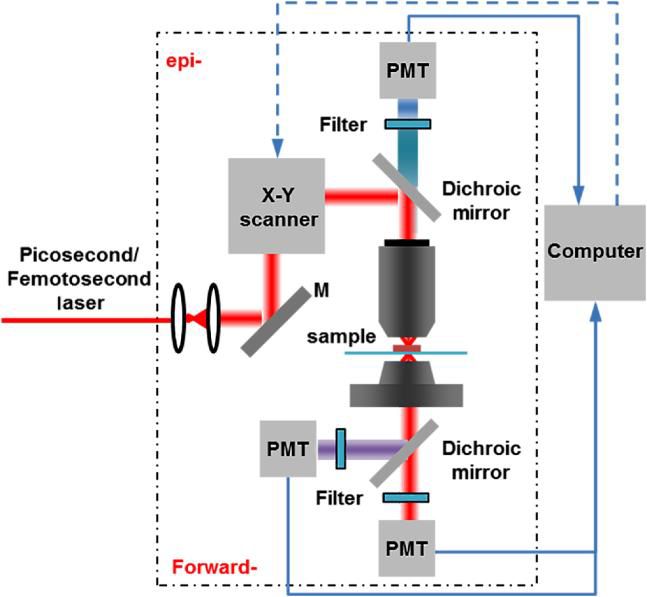
典型多光子显微镜主要由以下几个关键部分组成:
典型多光子显微镜结构示意图
1、激光光源
多光子显微镜需要高时空相干性的短脉冲激光来提高多光子效率,与传统宽场荧光显微镜采用的连续激光不同。锁模掺钛蓝宝石(Ti:Sapphire)激光器和光纤飞秒激光器是常用的光源,结合光参量振荡器(Optical Parametric Oscillator,OPO)或光参量放大器(optical parametric amplifiers,OCA)可获得波长更长的激光,通过改变相位匹配条件还能实现多波长宽带可调谐输出。不同成像场景对激光源的物理参数,如平均功率、脉冲持续时间、重复频率、激发波长和光谱带宽等有不同要求。
2、光学扫描模块
扫描模块对系统成像速度影响较大,目前多数多光子显微镜使用振镜进行2D扫描,同时共振扫描仪和一些非机械扫描机制的出现进一步提高了成像速度。
3、低倍率高数值孔径物镜
物镜从全视场收集信号,其数值孔径越大,收集到的光越多,分辨率越高。多光子显微镜通常配备高数值孔径物镜,并且要求物镜在近红外光波段具有高透过率,以减小激发光的损耗。在对高光散射样品成像时,低倍率高数值孔径物镜与高灵敏度、低噪声GaAsP光电倍增管配合使用可提高检测效率和图像信噪比。
4、二向色镜和光电探测器
激光源发出的光束经扫描器扫描后,通过二向色镜及物镜聚焦在样品上,激发样品产生荧光信号和谐波信号,这些信号被物镜收集并沿原光路返回,二向色镜将多光子激发的信号从激发光中分离出来,引导至光电探测器。通常多光子激发荧光成像和谐波成像可在同一装置上实现,通过在探测器前设置滤波片可在光谱上分离不同信号。
多光子脑成像成像深度进展
一、长波长激发
1、激发光和发射光衰减对成像深度的影响
在多光子脑成像中,激发光和发射光在生物组织中的衰减严重制约了成像深度。增加激光源脉冲能量虽能增强激发光穿透深度,但会带来诸多弊端,如提高激光系统成本和复杂性、诱发多光子电离和光损伤,以及导致失焦和近表面荧光激发等问题。
2、长波长激发的优势与实现方式
采用波长更长的激发光进行成像可显著减少组织散射和吸收,避免高能脉冲带来的问题,是提高成像深度的有效方法。目前多光子显微镜常采用Ti:Sapphire激光器产生的700-1100nm飞秒脉冲激发,为提升成像深度,研究人员开发了1300nm窗口(由光参量振荡器、光参量放大器或Cr:forsterite激光器产生)和1700nm窗口(由光孤子源激发)。这些窗口在脑组织中的衰减呈现局部*小值,有利于将弹道光子传递到焦点。例如,Demirhan Kobat等人采用1280nm激发对小鼠大脑中荧光标记的脉管系统成像,达到了散射组织中多光子成像的基本深度极限;Dimitre G.Ouzounov等人使用1300nm激发的三光子成像对小鼠海马体中的神经元成像,成像深度约1mm;H Cheng 等人采用圆偏振孤子自频移技术在1617nm处产生高能飞秒脉冲,对小鼠体内深脑脉管系统成像,深度达2000μm;Hongji Liu等人使用自制飞秒激光器进行1700nm窗口的三光子激发,实现了小鼠大脑表面以下2100μm血管的可视化及1600μm深度处的血流动力学成像。此外,2200nm窗口在生物组织中的衰减也呈局部*小值,但成像深度和空间分辨率不如1700nm激发,因此1700nm窗口仍是当前实现*深多光子脑成像的光学窗口。
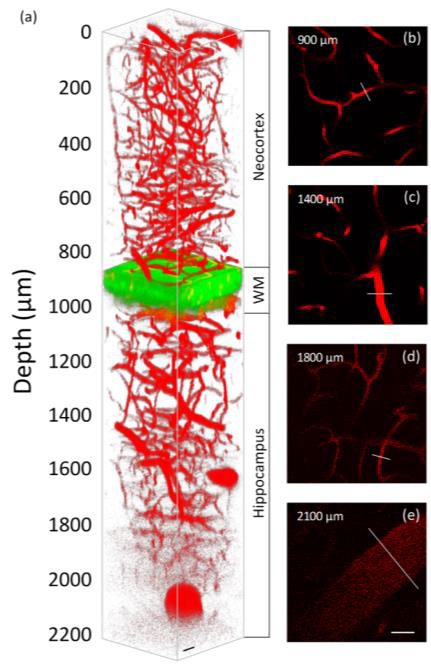
成年小鼠体内Qtracker655 标记的深脑脉管系统的三光子显微成像
二、结合自适应光学
1、成像质量下降的原因
尽管长波长激发可减轻散射效应,但随着成像深度增加,成像质量会迅速下降。这是因为不均匀的样本会使激发光的波前发生畸变,引入伪影。此外,高数值孔径油镜的浸入介质与样品之间的折射率不匹配、光学元件的离轴传输以及光学元件的缺陷等因素都会导致像差,使激发光的焦点光斑尺寸增大且强度减小,限制了深层组织的高质量成像。
2、自适应光学技术的应用与效果
自适应光学技术是解决多光子成像波前校正的主要方法,其典型系统包括波前探测和波前校正两个部分。波前探测分为直接波前测量法(利用波前传感器直接测量畸变波前,测量速度快,但需引入外源染料,不利于厚组织或多层样品)和间接波前探测法(基于迭代算法,通过一系列图像间接推导出波前,速度较慢但适合不透明介质,其替代方案如相干门控波前传感、瞳孔分割和自适应迭代补偿技术等广泛应用于脑部组织成像)。波前校正器(如可变形镜和空间光调制器)通过改变波前相位来校正畸变波前。
许多自适应光学技术已应用于多光子显微镜。S.Leemans等人开发的3D自适应光学系统,在显微镜激发路径中集成可变形镜,采用基于下坡单纯形算法的波前优化方法,能对小鼠大脑 2mm深度处的运动神经元成像,提高了图像分辨率和亮度;Lina Streich等人将自适应光学技术应用于三光子显微镜进行小鼠大脑活体成像,采用实时心电图门控图像采集方案减少运动伪影,结合基于模态的间接AO法与连续膜可变形镜,可对皮层和海马体中的精细结构成像,图像质量和空间分辨率显著改善,轴向分辨率提升四倍,荧光信号增强八倍。
三、结合GRIN透镜
1、现有措施的局限性与内窥镜检查方式的引入
尽管采取了上述措施,在小鼠大脑中成像深度仍限制在1-2mm。为对更深层皮质下结构成像,可采用内窥镜检查方式,通过插入薄成像探针观察器官内部,其中GRIN透镜被广泛用于大脑体内成像。
2、GRIN透镜的特点与应用实例
GRIN透镜是微型棒状透镜,具有接近抛物线形状的径向折射率曲线,直径可小于1mm,能嵌入组织内部传递激发和发射光。结合高数值孔径GRIN透镜的多光子内窥镜技术可解析深层组织亚细胞结构。例如,Miriam E.Bocarsly等人开发的微创多光子微内窥镜系统,采用0.5NA、直径0.5mm的GRIN透镜,结合遗传编码钙指示剂GCaMP6s,能对小鼠大脑深层结构(如纹状体、黑质和外侧下丘脑)的神经元和神经元活动进行双光子荧光成像;Masaaki Sato等人采用直径1.8mm、长度16.9mm的GRIN透镜和电可调透镜构成的快速变焦双光子微内窥镜系统,可使麻醉小鼠的CA1海马体和杏仁核神经元可视化;Yu-Feng Chien等人将GRIN透镜和可调谐声学GRIN透镜集成到双光子显微镜中,实现了对小鼠大脑底部视交叉上核自发神经元活动的体内功能成像。然而,GRIN透镜固有像差会限制成像分辨率和视野,可结合电可调液晶透镜、衍射和折射光学元件、自适应光学器件等进行校正。此外,GRIN透镜植入大脑可能导致组织创伤,开发非侵入性方法仍是深层脑组织成像的需求。
多光子脑成像成像速度进展
一、随机扫描
1、传统扫描机制的局限性与随机扫描的优势
多光子成像速度受激发焦点连续扫描速度限制,典型双光子显微镜帧速率较慢。传统多光子显微镜使用振镜进行2D扫描,虽有共振扫描仪等快速扫描机制,但仍受扫描镜物理速度限制且需克服惯性。随机扫描机制可有效避免这些问题,激光束能在整个视场任意选定点快速扫描,可只扫描感兴趣点,且由于激光束在信号产生区域停留时间增加,系统获取信号量增多,图像信噪比得以提高。
2、随机扫描的实现方法与补偿方案
实现随机扫描常用声光偏转器(AOD),其通过声光衍射效应使入射光在一定角度范围内扫描,扫描频率可250KHz,且所有扫描位置激光功率均匀,结合其他轴向扫描技术可实现3D随机扫描。例如,Kelly D.R.Sakaki等人开发的双光子显微镜采用两个AOD进行X轴和Y轴扫描及压电致动器进行Z轴扫描,能对神经元树突棘进行高分辨率饱和采样。然而AOD会引入空间和时间色散,导致脉冲展宽和光束失真,降低信号强度和图像质量。为解决此问题,研究人员开发了多种补偿方案,如使用扩散光栅等色散元件在相反方向引入空间色散来*小化量,或使用棱镜或额外AOD校正空间和时间色散,使基于AOD的扫描机制广泛应用于多光子显微镜,实现高时空分辨率的随机扫描。
二、多焦点成像
1、多焦点成像的原理与优势
多焦点成像通过同时激发和检测多个位置的信号来提高数据获取速度且不损失信噪比,成为提升多光子成像速度的策略。在多焦点成像中,一束平行光垂直入射到多焦点光学元件后在轴向或垂轴平面形成多个焦点,常用多焦点光学元件包括Nipkow盘、分束器阵列、微透镜阵列、衍射光学元件和空间光调制器等。
2、多焦点成像技术的应用与问题解决
Chenyang Wen等人利用二元全息图控制聚焦光点位置和强度,结合多焦点压缩传感算法重建3D图像,提高了成像性能;Simon P.Poland等人开发的多焦点多光子荧光寿命显微镜包含8×8快光束阵列,通过并行激发和检测使采集速度大幅提高。然而,多焦点多光子技术存在成像质量和速度的矛盾,增加焦点数目可提高速度,但会因焦点间相干干扰降低分辨率。通过不同光束的相位复用、使用不同偏振态光束以及延长每个焦点相对于相邻焦点的时间等方法可有效解决此问题。
三、贝塞尔光束照明
1、扩展焦深成像与贝塞尔光束的特点
在多光子三维成像中,传统扫描方式耗时多,扩展焦深成像通过牺牲轴向图像信息,利用贝塞尔光束扩展焦深,在一次横向扫描中实现体积扫描,可大大提高成像速度,适用于高时间分辨率的稀疏群体结构成像,如神经元活动的功能成像。贝塞尔光束具有轴向延展的针状光强度分布,在保持横向分辨率的同时延伸了焦深,能同时从不同深度获取信号。对于标记较稀疏的样品,长焦深贝塞尔光束可监测更大体积活动;对于标记密集的样品,短焦深贝塞尔光束可减少结构重叠。
2、贝塞尔光束在多光子显微镜中的应用实例
Bingying Chen等人将贝塞尔光束照明应用于三光子显微镜,对活果蝇大脑特定区域成像,速度达1Hz,相比点扫描三光子显微镜优势明显;Rongwen Lu等人开发的基于轴锥镜的贝塞尔光束模块成本低、占用空间小且对光偏振不敏感,集成到双光子荧光显微镜中对斑马鱼幼虫神经元成像,速度达50Hz,能对更多神经元成像;Jiang Lan Fan等人使用具有轴向扩展贝塞尔焦点的双光子激光扫描显微镜进行神经血管动力学成像,实现了大体积(1.4mm×1.4mm×110μm)和高速(99Hz)下的结构和功能成像,且横向分辨率足以解析单个毛细血管,表明贝塞尔焦点扫描在提高体积成像通量的同时不影响横向分辨率。
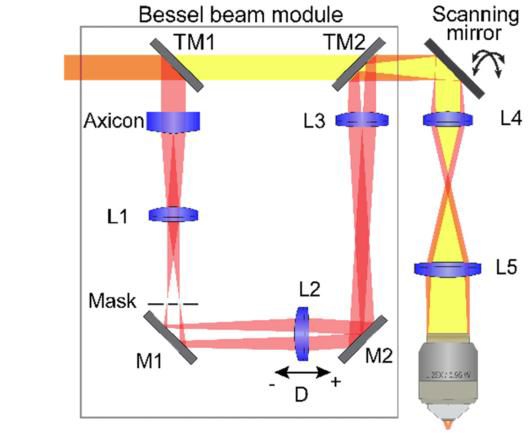
基于轴锥镜的具有连续可调焦深贝塞尔模块的光学原理图
多光子脑成像装置小型化
一、传统装置的局限性与小型化的必要性
传统多光子脑成像通常依赖大型台式显微镜,动物头部需固定在物镜下方,这严重限制了可研究的行为类型,给动物带来不适和压力。因此,将扫描机构、光学系统、信号收集组件和飞秒激光器小型化,发展头戴式多光子显微镜成为重要研究方向。
二、扫描机制与激光源的探索
研究人员探索了多种适用于微型双光子显微的扫描机制,其中光纤扫描头和微机电系统(Microelectro Mechanical Systems,MEMS)扫描镜较为常见。MPM的典型激光源 Ti:Sapphire快激光器体积庞大、对准要求高,不适用于临床环境,而光纤激光器结构紧凑、无需对准且价格便宜,在微型化系统中发挥重要作用。聚焦光学系统的小型化可通过使用紧凑的高数值孔径光学系统实现。
三、小型化显微镜的发展历程与实例
1、早期尝试与不足
2001年,Denk等人研制出*台光纤共振扫描双光子头戴式显微镜,但成像性能不佳。2009年,Kerr等人展示的小型化双光子光纤内窥镜系统虽空间分辨率有所提高(因应用微型物镜NA 0.9),但探头重量增加(5.5g),且由于仍使用光纤共振扫描,成像速度较慢。同年,M.J.Schnitzer等人建造的基于MEMS扫描仪的便携式双光子显微镜重量仅2.9g,*对小鼠大脑新皮质表面附近血管成像,但其扫描频率(对于400×135像素约为4Hz)和空间分辨率(横向分辨率约1.29μm,轴向分辨率约10.3μm)未达要求。
2、近年来的进展与突破
2018年,Baris N.Ozbay等人开发的头戴式双光子光纤耦合显微镜(2P-FCM)具有主动轴向扫描功能,采用电润湿可调谐透镜,操作简单、尺寸和重量小且不受振动影响,能快速改变3D成像焦点。该系统使用柔性相干光纤束作为光学继电器,结合台式激光扫描双光子显微镜,实现了大视场成像和一定深度的轴向扫描,成像横向分辨率为1.8μm,轴向分辨率为10μm,*对自由移动小鼠躯体感觉皮层神经元成像。
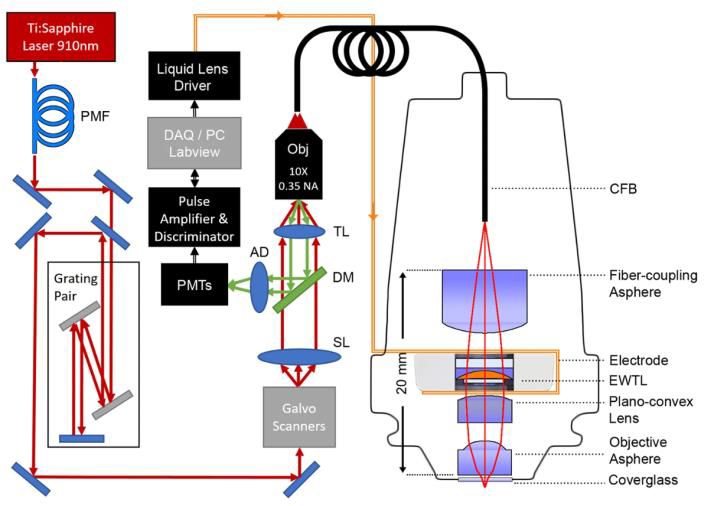
2P-FCM 成像系统
2019年,Jin Cheng等人简化双光子显微镜结构,定制二向色性MEMS扫描仪,形成小型线阵扫描非线性光学显微镜,尺寸小(约7mm×6.5mm×3mm),重量轻(0.25g),成像速度高达每秒数千帧,可同时在单个动物上安装多个(*多4个)进行成像。
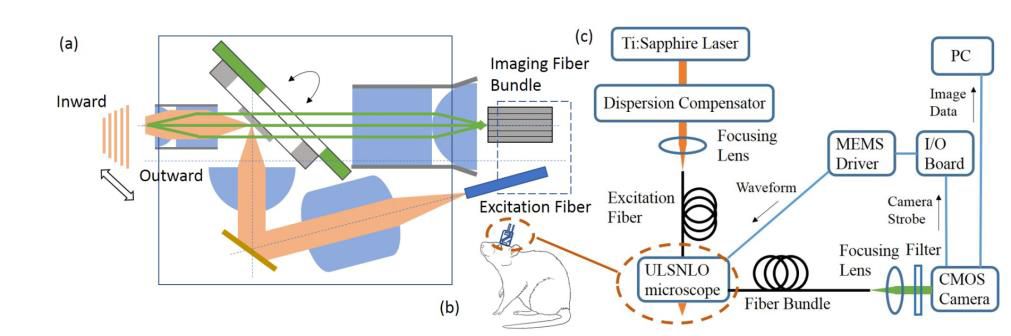
ULSNLO成像系统
2017年,Chen等人推出基于MEMS扫描仪的*头戴式双光子显微镜,使用920nm光子晶体光纤传输飞秒激光脉冲,性能与大型台式相当,重量仅2.15g,横向分辨率和轴向分辨率分别为0.64μm、3.35μm,栅扫描频率和线扫频率较高,可对自由移动小鼠中单棘活动成像。2021年,该团队研发的第二代快速、高分辨率、小型化双光子显微镜(FHIRM-TPM 2.0)成像视野扩大,嵌入可拆卸快速轴向扫描模块,实现了180μm深度的三维成像和多平面快速切换的实时成像,可长期追踪记录神经元,微型物镜工作距离扩展,变焦模块可自由拆卸,新版成像探头可整体即时拔插,简化实验操作,视场旋转角和边界偏差小,增强了微型双光子显微镜的适用性和实用性。
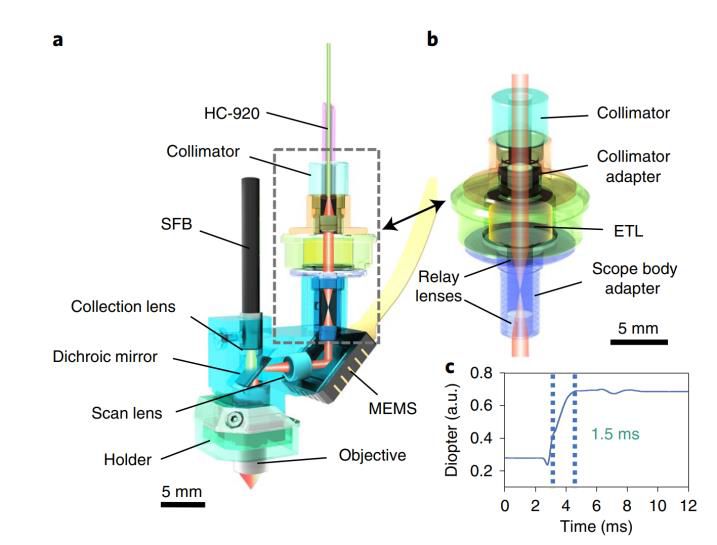
FHIRM-TPM 2.0成像系统
结与展望
多光子成像技术在脑科学研究中占据重要地位,其亚微米级空间分辨率、大成像深度、低生物损伤性和三维成像能力为研究大脑微观结构与生理过程、理解脑部疾病发病机制提供关键手段。
现有技术在成像深度上通过长波长激发、自适应光学模块和GRIN透镜等提升,成像速度借助随机扫描、多焦点成像和贝塞尔光束照明等提高,扫描机构等小型化发展出头戴式显微镜提高适用性。
未来,多光子成像将向多色成像(发展多波长激光等光源)、大视场多脑区成像(开发单个成像系统多区域成像技术)、集合多模态成像(结合其他技术增加探测维度)、结合5G与人工智能(实现高速数据传输与分析助力脑部疾病诊断)方向发展,尽管目前多光子脑成像研究在动物模型应用到人脑面临困难,但随着光学器件优化及数据处理方法改进,有望取得更多突破,为人类健康和科学发展助力。
声明:本文仅用作学术目的。文章来源于:薛璐, 徐彬, 熊吉川, 刘学峰. 多光子显微在脑成像中的应用及进展[J]. 激光与光电子学进展, 2023, 60(20): 02.







