荧光偏振成像技术及其生物学应用
来源:武汉光量科技有限公司
发布时间:2024-11-13 15:55:55
荧光偏振成像通过测量样品中荧光分子的偏振状态,得到样品的取向结构特征,在生物学领域有着广泛的应用。偏振成像常与其他荧光显微技术结合,用来解析细胞结构的排列方向、生物大分子的实时动态取向和组织的有序性等信息,以研究细胞的生理过程、药物对细胞的作用及异常结构的检测。

北京大学生物医学工程系的杨子仪团队发表文章,阐述了荧光偏振成像在生物学等领域的应用,对利用偏振信息获取不同样品取向结构的研究方法进行分析比较,并对其未来发展趋势进行展望。
荧光偏振成像技术原理
荧光偏振成像在生物学研究中具有重要意义,它通过测量样品内荧光分子的偏振状态,进而获取样品的取向结构特征。
荧光具有强度、波长、时间和偏振这四种特性,其中偏振方向与电场矢量方向一致。当用线偏振光激发荧光偶极子时,光子的吸收概率与激发光场和偶极子方向夹角的余弦平方成正比;*终探测概率也与辐射光场方向和探测器方向夹角的余弦平方成正比。因此,通过对发射光场方向和强度的探测,能够推断出荧光偶极子的角度取向,从而进一步研究样品结构特性,并且由于成像速度较快,该技术可用于活细胞样本的实时取向和动态结构分析。
主要的荧光偏振成像技术包括荧光各向异性(FA)、线性二向色性(LD)和散焦成像。这些技术能够对样品进行单分子或宽场成像观测。单分子成像可获取特定分子的取向和摆角,宽场成像则能得到一定区域内多个探针的平均取向和平均摆角。
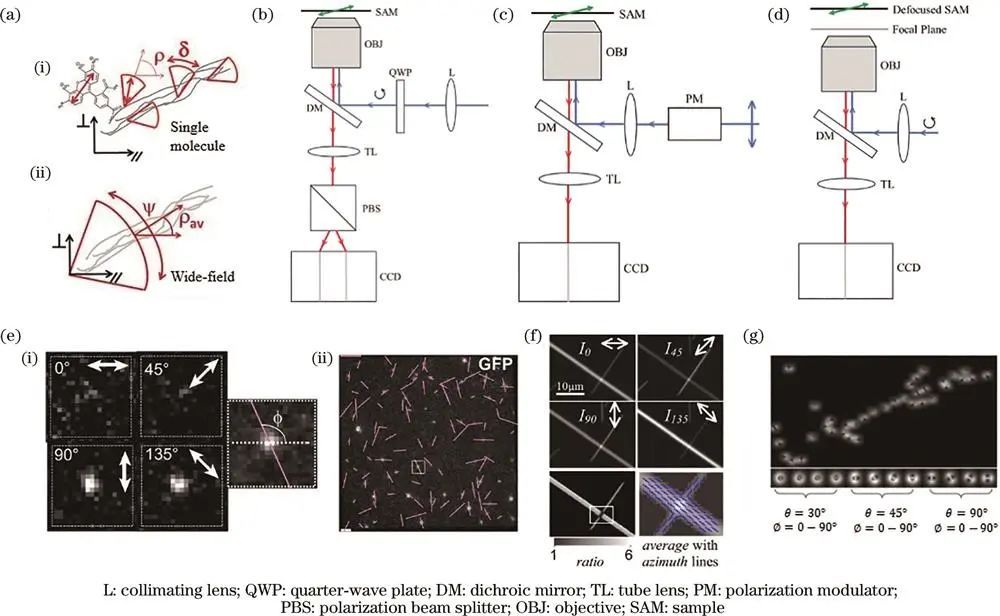
三种主要的荧光偏振成像技术
例如,荧光各向异性成像常采用圆偏振激发光,在探测光路中利用偏振分光棱镜将发射荧光分解为不同方向,通过特定公式计算得到偶极子的取向特征;
线性二向色性成像利用偏振调制器产生不同方向的线偏振激发光,记录荧光强度与激发光偏振态关系以获取样品取向信息;
散焦成像通过调节焦平面位置,根据物体散焦成像的双瓣状特征判断偶极子取向,但该方法成像结果较模糊,对成像系统信噪比要求较高。
此外,荧光偏振技术还可与共聚焦、结构光照明显微等多种显微技术相结合,在生物样本成像时,需综合考虑时间和空间分辨率等因素,权衡不同技术性能以满足生物学问题的成像需求。
在生物学各领域的应用
一、马达蛋白研究
马达蛋白包含动力蛋白、驱动蛋白和肌球蛋白,在细胞内利用ATP水解能量沿微管或肌动蛋白丝进行机械运动,参与物质运输、有丝分裂等重要生物学动态过程。
荧光偏振成像在研究马达蛋白动态方位角等性质方面发挥关键作用,有助于建立马达蛋白步进模型,对探究人体生命活动和马达蛋白异常相关疾病意义重大。
例如,Goldman课题组在2017年运用荧光偏振全内反射显微技术(polTIRF),将量子纳米棒连接在动力蛋白多肽部分环结构上进行成像,测量其在微管步进时环结构的位置与3D方位角变化,发现平均角度变化约为8°,与步长大小弱相关、与ATP浓度无关,进而提出基于杆的弯曲和铰接的新动力学模型。
对于驱动蛋白,Moerner课题组在2001年比较不同荧光探针标记效果并利用线性二色性荧光偏振显微镜研究其沿微管的取向性;Goldstein课题组同年运用荧光偏振技术测量驱动蛋白在不同核苷酸状态下的荧光偏振比,推断其取向灵活性并提出能量供应下的步进模型;Sosa课题组在2003年将研究推广至二聚体,标记驱动蛋白二聚体研究ATP水解过程中两个马达结构域的取向和相对构型,2009年又对ATP等待状态下的驱动蛋白进行标记和偏振成像,补充了能量供应下的驱动蛋白步进模型。
在肌球蛋白研究方面,Selvin课题组于2006年通过聚焦和散焦成像测量肌球蛋白V分子的3D取向和步进行为;Goldman课题组在2007年运用polTIRF技术研究肌球蛋白步进时与肌动蛋白丝的三维旋转角度关系,发现其运动区域和杠杆臂间存在柔性区域;2008年该课题组又用罗丹明标记肌动蛋白丝,测量肌球蛋白II和V步进时肌动蛋白丝绕轴旋转的方位角变化,探讨其旋转机制;2012年Yanagida课题组用高荧光量子棒标记肌球蛋白 V,研究其沿肌动蛋白丝运动与绕自身轴旋转角度关系,得出每步进一次绕自身轴旋转约90°的结论;2013年Goldman课题组利用时间相关的单光子计数技术,以高时间分辨率的polTIRF显微镜更地研究肌球蛋白的摆动特征。
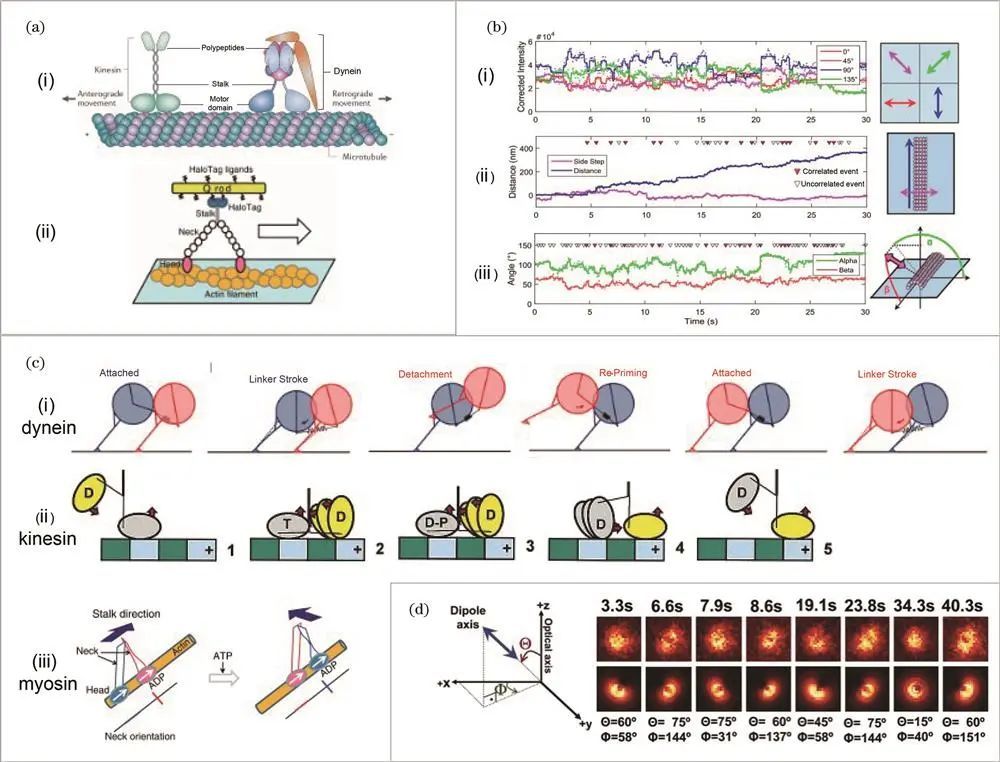
荧光偏振对马达蛋白的研究
二、细胞膜研究
膜结构及动态变化
生物膜作为磷脂双分子层,包含胆固醇和多种蛋白质,其结构对物质运输、信息交换和细胞内环境稳态等生命过程至关重要。荧光偏振可通过探针取向各向异性等参数反映膜结构形态及信号传导变化,为深入理解生物学机理提供依据。
众多技术手段被应用于该领域研究。2003年,Piston课题组使用标记GFP的MHC蛋白,通过激光扫描显微镜测量计算稳态各向异性,确定GFP和MHC单边刚性连接位置,并研究MCMV肽片段装载对各向异性的影响,为后续相关研究奠定基础。
2004年,Almers课题组运用全内反射显微镜,以正交方向偏振光激发样品观测荧光强度,根据s和p激发下的荧光强度变化研究染料在质膜中的扩散,辅助探究胞吐过程中的膜融合。
2010年,Anantharam课题组以di标记质膜,采用偏振全内反射荧光显微镜进行高时空分辨率成像,观察质膜胞吐与内吞时偏振参数的改变,研究质膜拓扑形态变化及相关蛋白在胞吐中的作用。
2011年,Brasselet课题组利用共聚焦荧光偏振显微成像技术,用GFP和di-8-ANEPPQ标记细胞膜蛋白MHCI和脂质,加入改变细胞骨架结构的药物,通过测量药物作用前后的偏振度推测摆角范围变化,研究细胞骨架对细胞膜形态的作用。
2013年,Brasselet课题组在前期研究基础上,利用傅里叶分析开发高精度共聚焦显微技术,以不同亲脂性探针标记脂质膜,研究膜拓扑结构在细胞骨架受影响和胆固醇消耗时的变化。
2022年,Lew课题组将偏振调制和光瞳分离技术结合,开发出高分辨率显微技术,以尼罗河红为探针标记脂质膜,通过不同通道强度反映偶极子相关信息,高精度研究膜的形态结构及流动性。
双光子荧光偏振技术也广泛应用于膜结构研究,如2005年French课题组用标记在膜不同方向的探针,运用双光子荧光偏振显微镜研究膜纳米管结构及胆固醇消耗对膜结构的影响;2009年Onfelt课题组使用双光子显微镜,通过归一化偏振参数反映探针有序性,测量自然杀伤细胞形成免疫突触期间的偏振参数,研究其细胞膜褶皱程度;2011年Lazar课题组运用具有较高线性二色性的双光子荧光偏振显微技术观察膜结构,研究G蛋白与其受体作用及钙离子浓度引起的钙传感器构象变化;2014 年Brasselet课题组运用可调线性二色性的双光子荧光偏振显微镜,开发数据分析方法,获取细胞膜上探针更的取向分布。
散焦成像技术同样在膜结构研究中有应用,2008年Dunn课题组通过散焦成像测量荧光脂质类似物在DPPC薄膜中的取向,发现其倾斜方向对表面压力的不同影响及胆固醇对脂膜有序性的作用;2013年Dunn课题组揭示GM1对脂膜特性的显著影响,如添加微量GM1会导致脂膜膨胀。
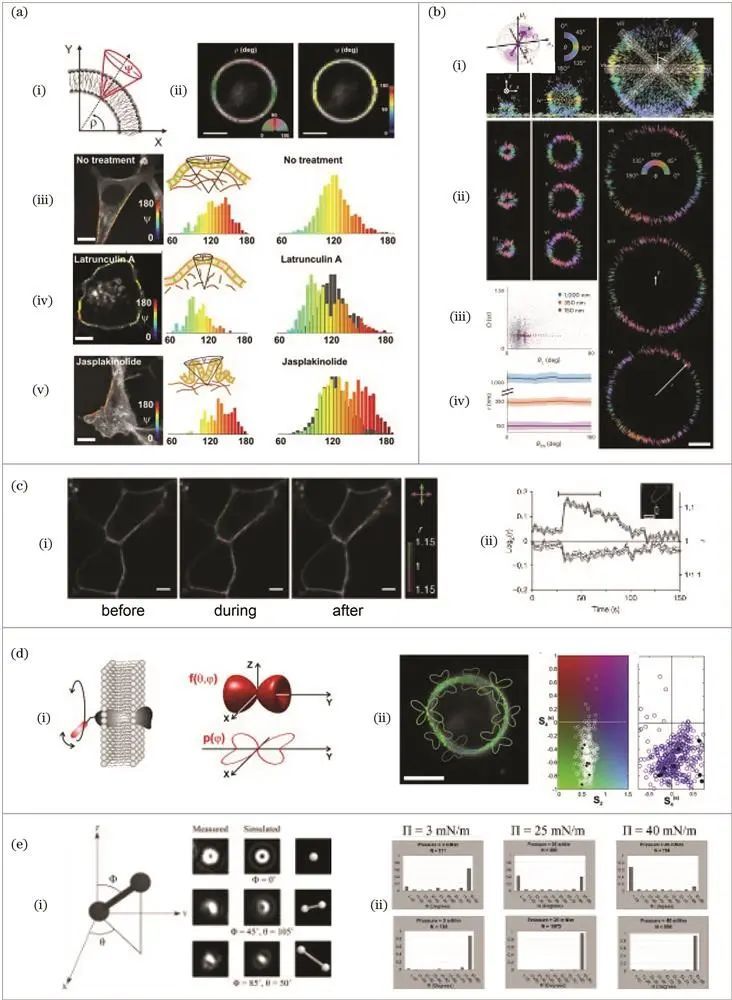
荧光偏振对膜结构的成像
膜相变化
随着对膜结构认识的深入,膜的流动镶嵌模型逐渐发展为更复杂的多相系统模型。荧光偏振可用于测量膜的体取向,分析不同液相结构的有序性。
例如,2001年Baird课题组用脂质探针标记膜结构,测量不同胆固醇浓度下的荧光各向异性,研究胆固醇对脂质有序性的作用及脂质筏在细胞膜中的存在比例。2008年Marques课题组采用双光子荧光偏振结合荧光寿命显微技术,用特定探针标记不同膜相构成的囊泡,测量探针荧光强度随囊泡轮廓角度的变化,建立不同相中探针取向势能模型。2009年Yip课题组运用荧光偏振全内反射显微镜和原子力显微镜联合成像,用多种探针标记膜结构,研究加入物质后膜相区域分布及分子有序性变化,探究膜破裂机制。2020年Lew课题组将单分子取向定位显微镜用于膜相分析,通过探针摆角取向范围区分不同膜相,并测量酶对膜相的改变,且该技术相比SMLM成像具有不受探针与膜结合时间影响和更高对比度的优势。
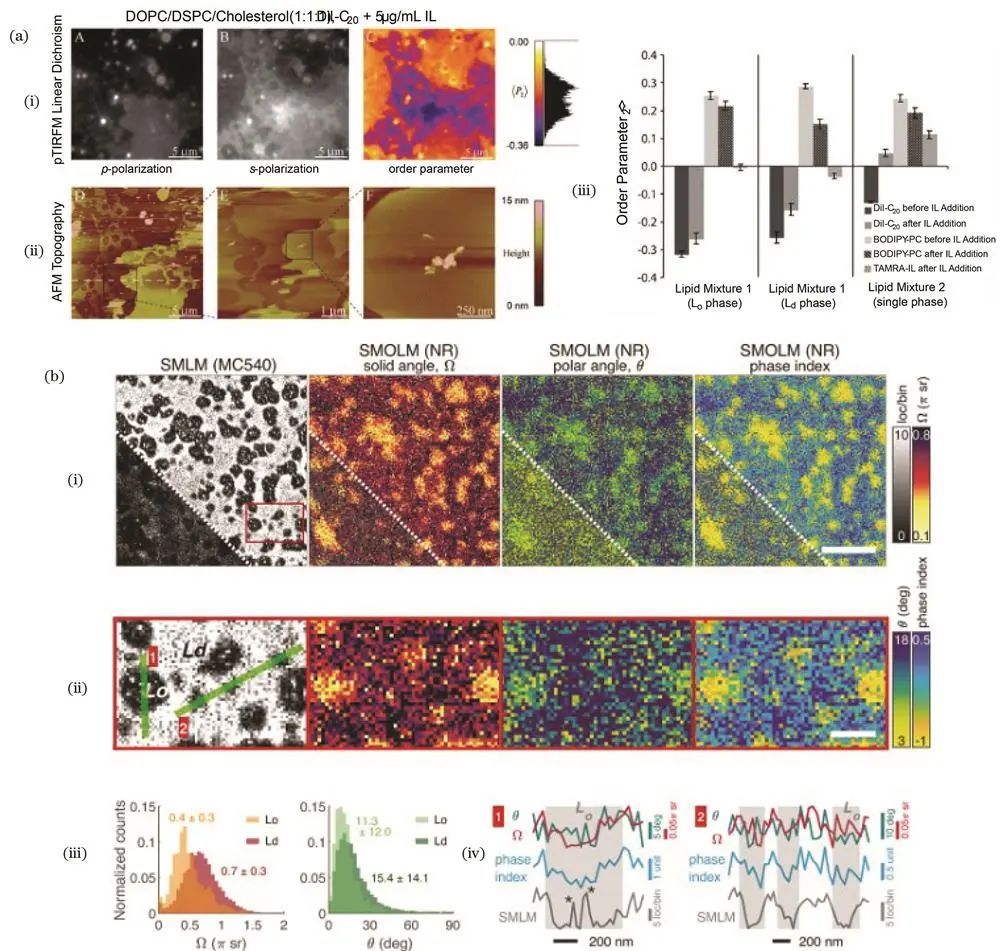
荧光偏振对膜相的研究结果
三、DNA研究
DNA作为人体主要遗传物质,其构象特征对基因表达调控有重要作用,除常见双螺旋结构外,还存在其他构型。荧光偏振可用于测量DNA链的结构取向,对药物设计极具价值。
2009年,汪海林课题组应用荧光偏振,通过正交偏振方向荧光强度相减去除未标记荧光染料影响,检测基因组甲基化水平。2016年,Moerner课题组以类似PAINT方法用λ噬菌体DNA进行体外研究,获得高分辨率偏振图像,明确SYTOX染料相对于非插层染料的标记模式,探究DNA链构象。
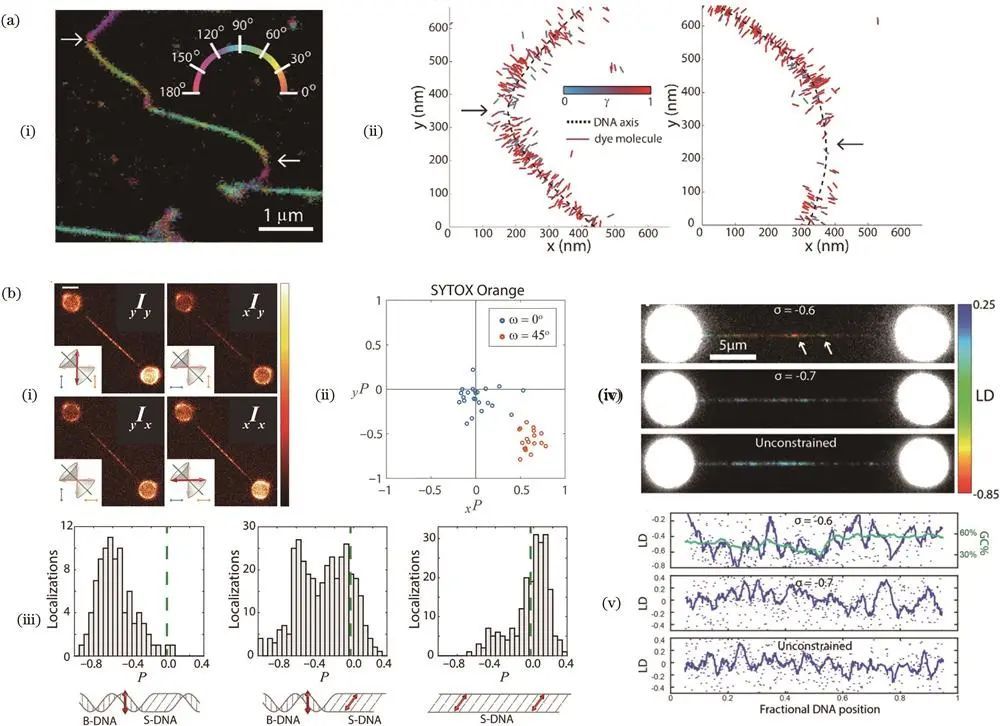
关于DNA的研究
2019年,席鹏课题组开发偏振结构光照明显微(pSIM)技术提高偏振成像分辨率,用SYTOX垂直插入标记DNA,清晰测量DNA细丝取向。2019年,Peterman课题组采用花青素嵌入剂标记DNA,结合宽场荧光偏振显微镜和光镊技术,测量DNA链受拉伸时的偏振参数,通过建模拟合分析不同阶段分子平均取向和摆角半径,为S-DNA形成提供证据;2021年该课题组进一步观察过度拉伸DNA的结构特征,证实P-DNA主要在富含A-T碱基对序列中形成,证明荧光偏振显微镜和DNA力谱相结合是研究过度拉伸DNA纳米级结构特征的有力手段。
四、细胞骨架研究
细胞骨架是真核细胞维持形态的重要结构,由微管、微丝、中间纤维和Septin等组成,荧光偏振显微技术为观察其结构及动力学变化提供新途径。
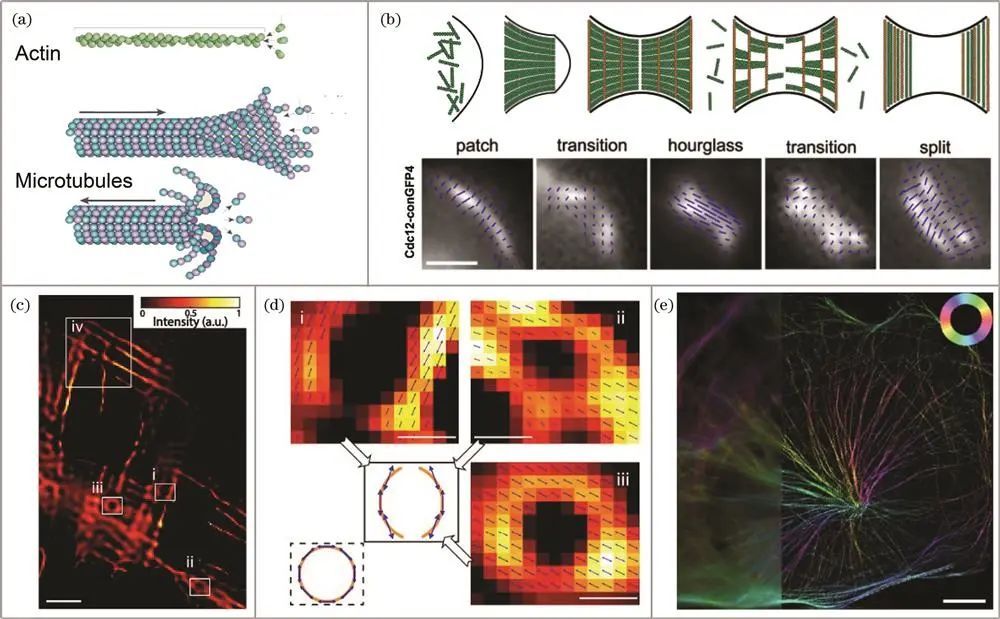
细胞骨架的研究
Septin:在酿酒酵母芽殖过程中,其结构动态变化备受关注。2006年,Vrabioiu和Mitchison使用septin-GFP融合体基因取代内源性基因,利用荧光偏振显微镜观察到从沙漏到环状转变时,septin细丝在膜平面旋转90°且整体形态构成圆周。2011年,DeMay课题组开创LC-PolScope技术,分析septin-GFP在酵母出芽过程中的取向变化,证实其高度组织化且与芽颈关系密切,明确芽殖酵母颈部区域septin-GFP的结构动力学。2015年,Abrahamsson课题组用多焦点偏振显微镜同时收集三维空间信息,分析胞质分裂时septin的重新排布,且可长时间成像酵母细胞。2016年,Mehta课题组使用瞬时荧光偏振显微镜,以单分子灵敏度和100ms时间分辨率成像活细胞中荧光团,追踪septin-conGFP颗粒位置和取向,确定其动力学特征。
微丝:由肌动蛋白螺旋状聚合而成,在细胞活动中作用显著。2016年,Brasselet组利用偏振分辨直接随机光学重建显微镜研究固定细胞中的肌动蛋白应力纤维,发现不同染料标记下与纤维方向的关系,证明该技术可作为定量指标观察细胞形状变化中肌动蛋白丝重组。同年,Mehta课题组使用瞬时荧光偏振显微镜和跟踪算法,分析活细胞中肌动蛋白网络结构动力学和肌动蛋白丝分子取向。2019年,高军涛课题组采用基于组稀疏性的分辨偶极子定向映射方法,发现肌动蛋白细丝中荧光分子偶极取向与细丝方向关系及在交叉处的三维共定位。2023年,席鹏课题组开发高速自偏振同步调制三维结构光照明显微镜,利用相关技术优势,准确分辨肌动蛋白丝取向分布。
微管:由微管蛋白和微管结合蛋白组成,结构特性重要。2014年,Walla课题组使用偏振解调分辨技术和激发偏振角缩窄技术,观察固定PtK2细胞中微管纤维细节,反映微管周围螺旋结构。2019年,席鹏课题组利用偏振光结构光显微技术对活U2OS细胞中微管成像,*观测偶极子方向动态变化,证实该技术可用于活细胞成像且分辨率优势明显。
其他应用领域
核孔复合物
核孔复合物是嵌入核膜孔隙的大型蛋白通道,介导核质运输。晶体学和单粒子电子显微镜虽能获取部分核孔蛋白高分辨率结构,但无法解决其排列等问题。2010年,Mattheyses课题组利用大分子复合体对称性和组织结构,开创荧光各向异性方法,用GFP标记核孔蛋白,观察活酵母中蛋白质结构域有序或无序状态,揭示个别蛋白质结构域物理排列信息及核孔结构动态变化,明确刚性和柔性结构域特征。2011年,Kampmann课题组提出用偏振荧光显微镜研究活酵母和哺乳动物细胞中核孔蛋白方向的方法,结果符合*模型。
海马神经元
其结构精细,研究其结构有助于理解神经系统功能。2014年,Hafi课题组使用偏振解调分辨和激发偏振角缩窄技术,对海马神经元棘成像,实现宽视场成像且穿透深度优于基于TIRF的方法,双光子激发时穿透深度更大。2016年,席鹏课题组将稀疏反卷积和*小二乘估计应用于荧光偏振调制数据,发现海马神经元树突棘颈偶极子取向非均匀分布,表明可能存在双膜结构且颈部两侧荧光分子取向形态有差异。2022年,清华大学高军涛课题组使用光学锁定检测分辨偶极子定向映射技术,观察到活体神经元树突棘扩张和收缩的各向异性变化,揭示其形态和方向动态,推动突触活动研究。
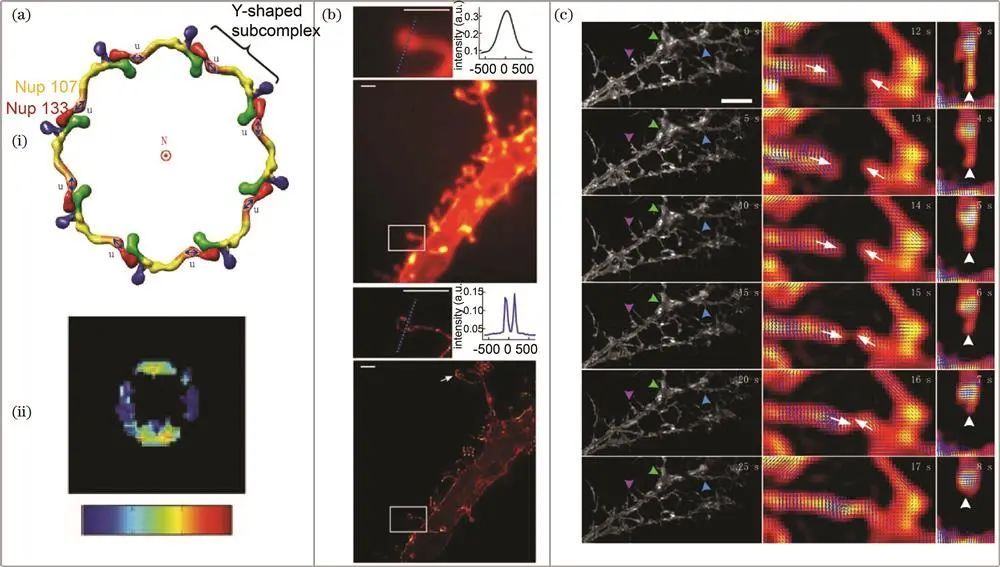
核孔复合物和海马神经元的研究
巨噬细胞
在机体生理过程中作用关键,与多种疾病相关。2018年,席鹏课题组通过散焦分析确认SERS纳米棒的各向异性效应,在巨噬细胞中用其标记囊泡,实现亚衍射分辨率成像,动态跟踪记录轨迹和方向信息,揭示亚细胞器微结构。
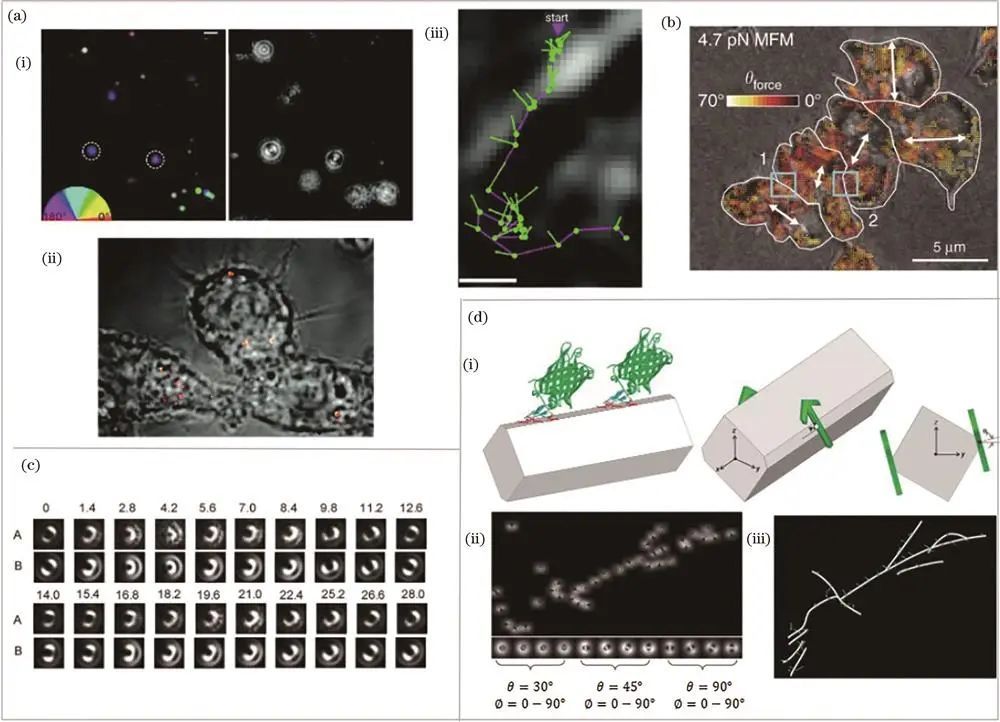
通过散焦成像获取偏振信息
细胞力
对生物过程不可或缺,获取细胞力信息有助于理解生命活动机制。2018年,Salaita课题组利用分子张力探针和荧光偏振显微镜测量小鼠成纤维细胞和人血小板中细胞力大小和3D方向,绘制牵引力方向,发现血小板受力结构与受力方向一致性及凝块结构和力学特征的各向异性和空间异质性。
聚合物动力学
聚合物行为复杂,其物理性质和动力学机制有待深入理解。散焦成像可同时观察众多分子,为研究聚合物分子旋转扩散提供可能。2004年,Enderlein课题组通过散焦宽场成像探测单个分子发射模式变化,为相关跳跃模型提供证据。2006年,该课题组跟踪分子在玻璃聚合物薄膜中的3D旋转扩散,观察到多组分旋转扩散衰减,反映聚合物不同弛豫状态和局部环境快速变化。
纤维素酶
提升其酶效率对生物燃料生产意义重大,研究其与底物相互作用及动力学机制有助于优化生物燃料生产。2011年,Smith课题组通过单分子荧光散焦成像,观察到单个碳水化合物结合块与结晶纤维素在水环境中的位点特异性结合,明确结合方向,为结合机制提供原位物理证据。
结论与展望
荧光偏振显微成像技术利用荧光分子偶极取向信息研究生物结构,能揭示分子取向,提供比传统荧光成像更多信息,在解析复杂生物大分子结构和还原生命活动动态过程方面应用广泛,且可与多种成像模式结合,为分辨荧光成像提供思路和帮助,如开创分辨荧光偏振显微技术,提供高分辨率和详细取向信息的成像结果。
展望未来,该技术有望进一步发展。自适应光学可校正像差,在3D偶极子信息提取或深层组织矢量成像中发挥重要作用;无标记偏振显微镜可与荧光偏振显微技术互补,获取更多微观结构信息;光电关联显微技术结合多种技术优点,可提供高分辨率细胞环境特定事件成像,荧光偏振显微技术与之结合有望提升成像效果;与电子显微镜结合可为生物学家提供更有效的研究工具;同时,该技术在分辨率和偏振信息分析能力方面将不断优化,在生物学领域发挥更广泛有效的应用。
声明:本文仅用作学术目的。文章来源于:杨子仪,李世晗,刘芷如,钟素艺,李美琪,席鹏.荧光偏振成像技术及其生物学应用[J].激光与光电子学进展,2024, 61(18):1800001.Ziyi Yang,Shihan Li,Zhiru Liu,Suyi Zhong,Meiqi Li,Peng Xi.Biological Applications of Fluorescence Polarization Imaging[J].Laser & Optoelectronics Progress,2024,61(18): 1800001.
温馨提示:为规避购买风险,建议您在购买产品前务必确认供应商资质及产品质量。
